BELAJAR MUDAH TERMODINAMIKA DENGAN MENGGUNAKAN MEDIA PEMBELAJARAN
Kompetensi Inti
KI
1 :
|
Menghayati
dan mengamalkan ajaran agama yang dianutnya
|
KI
2 :
|
Menunjukkan
perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerja sama,
toleran, damai), santun, responsif, dan pro-aktif sebagai bagian dari solusi atas
berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan
sosial dan alam serta menempatkan diri sebagai cerminan bangsa dalam
pergaulan dunia
|
KI
3 :
|
Memahami,
menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan
rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan
humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban
terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan
prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya
untuk memecahkan masalah.
|
KI
4 :
|
Mengolah, menalar, dan menyaji dalam ranah
konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya
di sekolah secara mandiri, dan mampu menggunakan metode sesuai kaidah
keilmuan
|
Kompetensi Dasar
3.7
|
Menganalisis
perubahan keadaan gas ideal dengan menerapkan hukum Termodinamika
|
4.7
|
Membuat
karya/model penerapan hukum I dan II Termodinamika berikut presentasi makna
fisisnya
|
Indikator
1. Menggambarkan
perubahan keadaan gas dalam diagram PV
2. Mendeskripsikan
dan memformulasikan usaha pada gas dengan berbagai proses
3. Mendeskripsikan
usaha, kalor, dan energi dalam berdasarkan hukum utama termodinamika
4. Menganalisis
proses gas ideal berdasarkan grafik tekanan-volume (P-V)
5. Mendeskripsikan
prinsip kerja mesin Carnot
Tujuan
1. Siswa
mampu menjelaskan sifat-sifat gas ideal monoatomik melalui diskusi dengan
benar.
2. Siswa
mampu menentukan hubungan besaran-besaran yang menjelaskan tentang keadaan gas
baik dengan hukum Boyle-Guy Lussac maupun dengan persamaan umum gas melalui
materi yang disajikan.
3. Siswa
mampu menjelaskan berlakunya hukum I dan II Termodinamika pada suatu proses
sistem gas melalui gambar materi yang disajikan.
4. Siswa
mampu menentukan usaha, perubahan energi dalam dan perubahan kalor pada proses
termodinamika melalui gambar yang disajikan.
5. Siswa
mampu menerapkan siklus Carnot pada mesin kalor dengan gambar dan simulasi yang
disajikan.
MATERI
A. Pengertian
Termodinamika adalah cabang ilmu
fisika yang membahas tentang hubungan antara panas (kalor) dan usaha yang
dilakukan oleh kalor tersebut. Dalam
melakukan pengamatan mengenai aliran energi antara panas dan usaha ini dikenal
2 istilah, yaitu Sistem dan Lingkungan.
1. Perubahan Keadaan Gas
Berdasarkan hukum Boyle-Gay Lussac, persamaan keadaan gas dapat dituliskan sebagai:
P1V1/ T1 : P2V2/T2
2. Besar Usaha Yang Dilakukan Gas
Besarnya
usaha yang
dilakukan
gas adalah :
W=F. ∆s
dW=F.ds
dW=P.A.ds
dW=P.dV
W = ∫ P.dV
B. USAHA YANG DILAKUKAN GAS
Terdapat beberapa proses usaha yang dilakukan gas, yaitu sebagai berikut:
a. Usaha Yang Dilakukan Gas Pada Proses Isotermal
Proses isotermal adalah proses perubahan
keadaan sistem pada suhu tetap. Proses tersebut sesuai dengan Hukum Boyle,
yaitu PV = konstan . Usaha yang dilakukan
sistem dapat ditentukan menggunakan persamaan:
Persamaan gas ideal:
PV = nRT
P = nRT/V
b. Usaha Yang Dilakukan Gas Pada Proses Isokhorik
Proses isokhorik adalah proses perubahan
keadaan sistem pada volume tetap. Pada proses isokhorik, sistem tidak mengalami
perubahan volume (V1=V2) sehingga besarnya usaha
luar yang dilakukan gas adalah:
c. Usaha Yang Dilakukan Gas Pada Proses Isobarik
Proses isobarik adalah proses perubahan keadaan
sistem pada tekanan tetap. Pada proses isobarik, tekanan gas diusahakan tetap
sehingga perubahan suhu pada gas akan menimbulkan perubahan volume gas untuk
mempertahankan agas tekanan gas tetap. Persamaannya adalah:
4
d. Usaha Yang Dilakukan Gas Pada Proses Adiabatik
Pada proses ini tidak ada kalor yang
diserap atau dilepas, sehingga usaha luar yang dilakukan oleh gas berasal dari
perubahan energi dalam gas.
CONTOH SOAL!
Suatu gas
ideal pada suatu silinder dalam suatu piston volume mula-mula 1,5
liter mengalami perubahan secara isobarik pada tekanan 105
Nm-2 Sehingga volumenya menjadi 2
liter. Berapakah besarnya usaha yang
dilakukan gas tersebut ?
Diketahui :
V1
: 1,5 liter = 1,5.10-3 m3
V2
: 2,0 liter = 2,0.10-3 m3
P : 1,5 N/m2
Ditanyakan : W =…….
Jawab :
W = P.ΔV
=
1,5.105. 0.5
=
7,5.104 joule
C. HUKUM I TERMODINAMIKA
Pada hukum I termodinamika panas netto yang
ditambahkan pada suatu sistem sama dengan perubahan energi
internal sistem ditambah usaha yang
dilakukan sistem, sehingga persamaan sebagai berikut:
Salah satu yang termasuk hukum I Termodinamika adalah mesin carnot. Mesin carnot adalah sebuah mesin kalor yang bekerja dengan cara mentransfer energi dari daerah yang panas ke daerah yang dingin. Dalam proses ini mesin carnot akan mengubah sebagian energi menjadi usaha mekanis. Dengan kata lain, mesin carnot dapat mengubah energi kalor menjadi energi mekanik.
Q=ΔU
+ W
Salah satu yang termasuk hukum I Termodinamika adalah mesin carnot. Mesin carnot adalah sebuah mesin kalor yang bekerja dengan cara mentransfer energi dari daerah yang panas ke daerah yang dingin. Dalam proses ini mesin carnot akan mengubah sebagian energi menjadi usaha mekanis. Dengan kata lain, mesin carnot dapat mengubah energi kalor menjadi energi mekanik.
Pada siklus carnot
terdiri dari dua proses, yaitu proses adiabatik dan proses isotermal. Proses Isotermal
adalah suatu keadaan dimana sistem tetap pada suhu konstan. Sedangkan, proses
adiabatik adalah suatu keadaan dimana tidak adanya energi kalor yang
dipindahkan ke luar ataupun ke dalam sistem. Dari gambar dibawah ini terapat
beberapa proses yang dialami oleh siklus carnot, yaitu sebagai berikut:
- Proses AB adalah pemuaian isotermal pada suhu T1. Pada proses ini sistem menyerap kalor Q1 dari reservoir bersuhu tinggi T1 dan melakukan usaha WAB.
- Proses BC adalah pemuaian adiabatik. Selama proses ini berlangsung suhu sistem turun dari T1 menjadi T2 sambil melakukan usaha WBC
- Proses CD adalah pemampatan isoternal pada suhu T2. Pada proses ini sistem menerima usaha WCD dan melepas kalor Q2 ke reservoir bersuhu rendah T2.
- Proses DA adalah pemampatan adiabatik. Selama proses ini suhu sistem naik dari T2 menjadi T1 akibat menerima usaha WDA
Untuk siklus Carnot berlaku hubungan Q2/T2=Q1/T1, sehingga efisiensi mesin Carnot dapat dinyatakan sebagai berikut.
η = ( W/Q1)x100%
= (1 – Q2/Q1)x 100%
= (1 – T2/T1) x 100%η = ( W/Q1)x100%
= (1 – Q2/Q1)x 100%
= (1 – T2/T1) x 100%
D. HUKUM II TERMODINAMIKA
Hukum II Termodinamika memberikan batasan-batasan terhadap
perubahan energi yang mungkin terjadi dengan beberapa perumusan.
1. Tidak mungkin membuat mesin yang bekerja dalam satu siklus,
menerima kalor dari sebuah reservoir dan mengubah seluruhnya menjadi energi
atau usaha luas (Kelvin Planck)
2. Tidak mungkin membuat mesin yang bekerja dalam suatu siklus
mengambil kalor dari sebuah reservoir rendah dan memberikan pada reservoir
bersuhu tinggi tanpa memerlukan usaha dari luar (Clausius).
3. Pada proses reversibel, total entropi semesta tidak berubah
dan akan bertambah ketika terjadi proses irreversibel (Clausius).
Bunyi Hukum II Termodinamika
Untuk menjelaskan tidak adanya reversibilitas para ilmuwan
merumuskan prinsip baru, yaitu Hukum II Termodinamika, dengan pernyataan:
“kalor mengalir secara alami dari benda yang panas ke benda yang dingin, kalor
tidak akan mengalir secara spontan dari benda dingin ke benda panas”.
a) Pengertian Entropi
Termodinamika menyatakan bahwa proses alami cenderung
bergerak menuju ke keadaan ketidakteraturan yang lebih besar. Ukuran
ketidakteraturan ini dikenal dengan sistem entropi. Entropi merupakan besaran
termodinamika yang menyerupai perubahan setiap keadaan, dari keadaan awal
hingga keadaan akhir sistem. Semakin tinggi entropi suatu sistem menunjukkan
sistem semakin tidak teratur. Entropi sama seperti halnya tekanan dan
temperatur, yang merupakan salah satu sifat dari sifat fisis yang dapat diukur
dari sebuah sistem. Apabila sejumlah kalor Q diberikan pada suatu sistem dengan
proses reversibel pada suhu konstan, maka besarnya perubahan entropi sistem
adalah :
ΔS = Q/T
ΔS = perubahan entropi ( J/K)
Q = kalor ( J)
T = suhu (K)
b. Mesin Pendingin
Mesin pendingin merupakan peralatan yang prinsip kerjanya
berkebalikan dengan mesin kalor. Pada mesin pendingin terjadi aliran kalor dari
reservoir bersuhu rendah ke reservoir bersuhu tinggi dengan melakukan usaha
pada sistem. Contohnya, pada lemari es (kulkas) dan pendingin ruangan (AC).
Bagan mesin pendingin dapat dilihat pada gambar berikut.
Ukuran kinerja mesin pendingin yang dinyatakan dengan
koefisien daya guna merupakan hasil bagi kalor yang dipindahkan dari reservoir
bersuhu rendah Q2 terhadap usaha yang dibutuhkan W.
dengan:
Kp = koefisien daya guna
W = usaha yang diperlukan ( J)
Q1 = kalor yang diberikan pada reservoir suhu tinggi ( J)
Q2 = kalor yang diserap pada reservoir suhu rendah ( J)
T1 = suhu pada reservoir bersuhu tinggi (K)
T2 = suhu pada reservoir bersuhu rendah (K)
c. Koefisien Performasi Mesin Pendingin (COP*)
Koefisien performasi mesin pendingin adalah perbandingan
antara panas yang diambil dari tandon dingin (Q1)dengan pemakaian usaha (W).
COP
= Q1/W
CONTOH SOAL!
Sebuah lemari pendingin memerlukan usaha 150 joule
untuk memindahkan kalor sebesar 100
joule dari tandon bersuhu rendah ke tandon bersuhu tinggi. Tentukan koefisien kerja lemari pendingin tersebut !
Jawab:
Dik:
W = 150 joule
Q2= 100
joule
COP = Q2/W
= 100/150
= 0,67
1.
Pada termodinamika, gas ideal mengalami proses isotermik jika..
a. Perubahan keadaan gas suhunya selalu
tetap
b. Semua molekul bergerak dengan kecepatan
berbeda
c. Semua keadaan gas suhunya selalu berubah
d. Pada suhu tinggi kecepatan molekulnya
tinggi
e. Tekanan dan volume tidak mengalami
perubahan
2. 1,5 m^3 gas helium yang bersuhu 27℃
dipanaskan secara isobarik sampai 87℃.
Jika tekanan gas helium 2×〖10〗^5 N/m^2, gas helium melakukan usaha luar
sebesar...
a. 60 kJ
b. 120 kJ
c. 280 kJ
d. 480 kJ
e. 660 kJ
3. Suatu
mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi
40%. Jika reservoir panasnya bersuhu 640 K, berapakah efisiensinya...
a. 50,0 %
b. 52,5 %
c. 57,0 %
d. 62,5 %
e. 64,0 %









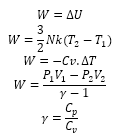








0 komentar:
Posting Komentar